Comment
le magnétisme vient aux molécules
… et le monde merveilleux qui en résulte
Le
mot magnétisme, utilisé dans la vie de tous les jours, évoque
généralement des matériaux solides, métaux,
alliages, oxydes. Les molécules sont elles, le plus souvent considérées
comme des objets isolés, non magnétiques. Pourtant, être
ou ne pas être (magnétique) n’est pas la vraie question
: tout est magnétique. Le vrai problème est de savoir comment.
Cet exposé propose d’illustrer le magnétisme des molécules
à partir de quelques expériences,
Du magnétisme
des aimants à celui de la molécule
Dans la vie quotidienne, les corps que l’on appelle « aimants
» peuvent être classés en deux catégories : les
aimants « durs » et les aimants « doux ». Les aimants
durs restent aimantés en permanence (« aimantation rémanente
» importante) et peuvent attirer à eux les aimants doux qui
perdent ensuite rapidement leur aimantation (« aimantation rémanente
» faible ou nulle). Les aimants durs (alliage neodyme-fer-bore par
exemple) créent autour d’eux un champ magnétíque
qu’on peut visualiser à l’aide de matériaux doux
(expérience des lignes de flux magnétique de M. Faraday, Figure
1).
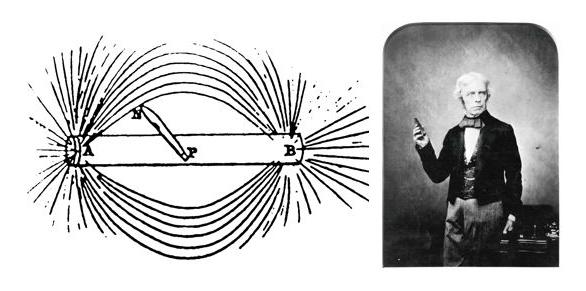
Figure
1 : Première illustration des lignes de champ magnétique autour
d’un aimant permanent, matérialisées par de la limaille
de fer (1832) ; Michael Faraday tenant un aimant.
(communication privée, P. Day et F. James, Royal Institution, Londres).[Voir
aussi : P. Day, The Philosopher’s Tree,The Institute of Physics Publishing,
Bristol, 1999]
Le fait que le
champ magnétique ne soit pas visible, que les interactions magnétiques
s’exercent à distance, sans contact direct, comme l’illustrent
les expériences très populaires de lévitation (figure
2), peuvent être utilisés de manière mercantile et abusive
par des charlatans. La théorie du « magnétisme animal
» de Messmer, auquel Mozart fait allusion dans la scène IV
de Cosi Fan Tutte (« pietra mesmerica ») a fait bien des victimes
trop crédules avant que son créateur ne se retrouve en geôle
pour escroquerie. Dans le langage quotidien, le charme et le charisme de
certaines personnes, de leurs yeux notamment, est souvent qualifié
de « magnétique » : Fernande Olivier, l’une des
premières compagnes de Picasso, confesse que le 4 août 1904
… « Ce rayonnement, ce feu intérieur que l’on sentait
en lui, dégageaient une espèce de magnétisme à
quoi je ne résistai pas … ». Les exemples abondent.

Figure
2 : Corps en lévitation : une toupie en rotation à gauche,
un globe terrestre à droite lévitent. Leur poids est exactement
opposé à la force magnétique exercée par des
aimants sur la substance aimantée dont ils sont constitués.
L’interaction s’exerce sans contact direct et lui confère
indûment un caractère étrange et « magique ».
L’utilisation la plus connue et l’une des plus utiles du magnétisme,
– elle a servi notamment dans la panoplie des instruments de navigation
qui au XVe siècle ont permis les grandes découvertes, en Espagne,
au Portugal, en Chine … - est évidemment la boussole dont l’aiguille
s’oriente dans le champ magnétique terrestre dû lui-même
aux masses métalliques du noyau terrestre (figure 3). Inventée
en Chine, la boussole a été mise en boîte par les Italiens
de la côte amalfitaine, d’où son nom (bussola en italien
= petite boite). Les jouets magnétiques suscitent souvent les passions
enfantines (figure 4).
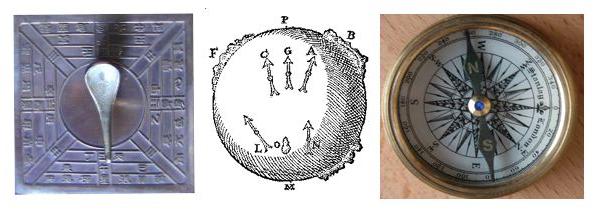
Figure 3 : une application bien connue du magnétisme,
la boussole : du modèle Si Nan du musée d’histoire
de Beijing à la terrella de William Gilbert (de Magnete, 1600)
et à une boussole moderne de collection.

Figure 4 : les jeux de construction à base d’éléments
magnétiques n’engendrent pas la mélancolie des jeunes
enfants.
Les « magnets
» qui ornent bien des portes de réfrigérateurs et de
tableaux d’affichage ne sont pas moins répandus. Aimants durs
et aimants doux occupent une part considérable dans le fonctionnement
des moteurs de véhicules automobiles, les transformateurs, etc …
Une grandeur particulièrement importante pour caractériser
les matériaux magnétiques est la température dite
de Curie (Tc), mise en évidence par Pierre Curie, qui indique la
température de passage d’un état magnétique
ordonné à longue distance à un état désordonné.
L’expérience dite du clou (la température de Curie
du fer est de 770º Celsius), consiste à chauffer un clou de
fer suspendu à un pendule, jusqu’à ce qu’il
ne soit plus attiré par un aimant (à la température
de Curie). Elle peut être réalisée plus aisément
avec un matériau dont la température de Curie est proche
de la température ambiante. En effet, certains matériaux
moléculaires aimantés deviennent paramagnétiques
par simple chauffage par un rayon lumineux (figure 5).
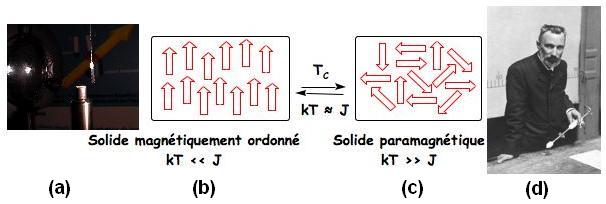
Figure 5 : Température de Curie : (a) expérience
du « clou » ; au centre, modélisation du passage d’un
solide magnétique désordonné (c) à un solide
magnétiquement ordonné (b) quand l’interaction entre
moments magnétiques devient du même ordre de grandeur que
l’agitation thermique ; (d) Pierre Curie réalisant des expériences
dans l’amphithéâtre de Physique, 12 rue Cuvier (origine
du cliché : musée Curie, Paris).
Lorsque l’on
examine un aimant, on peut observer qu’il est constitué de
« domaines » magnétiques » eux-mêmes constitués
de nombreux moments magnétiques, le stade ultime étant le
moment magnétique porté par un seul atome ou une seule molécule
(figure 6).
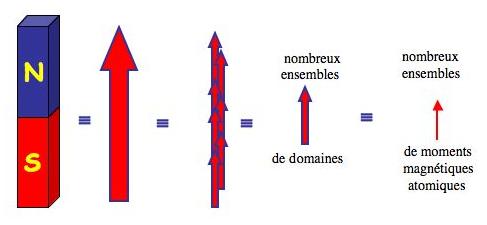
Figure
6 : Schéma de décomposition d’un aimant en domaines
et en moments magnétiques ;
Lorsqu’on
applique un champ magnétique sur un aimant, on peut changer la
direction de l’aimantation (la manière dont le matériau
s’aimante), jusqu’à la renverser. Le renversement de
l’aimantation affecte de manière différente les divers
domaines. La courbe qui donne l’aimantation en fonction du champ
appliqué comporte le plus souvent un cycle d’hystérésis
lors du balayage du champ de fortes valeurs positives à de fortes
valeurs négatives (Figure 7). Le cycle d’hystérésis
dépend énormément du système comme le montre
la figure 7.
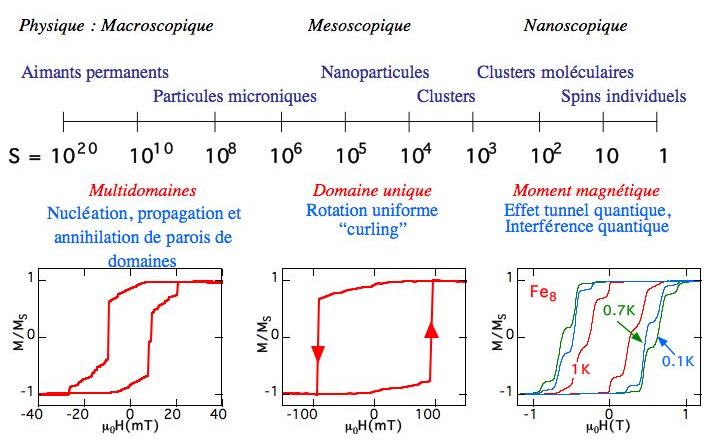
Figure 7 : de la physique macroscopique à la
physique nanoscopique, de la physique des domaines à la physique
quantique (adapté de W. Wernsdorfer, I.L. Néel, Grenoble)
: la variation de l’aimantation en fonction du champ magnétique
appliqué présente un cycle d’hystérésis
dont la nature est complètement différente selon la taille
des moments magnétiques. Le magnétisme de la molécule
(à droite) est dominé par les phénomènes quantiques.
Tout cela participe
du magnétisme dit « classique », macroscopique, à
notre échelle avec d’innombrables applications utiles. Pour
le commun des mortels, les molécules quant à elles n’entrent
pas dans cette catégorie « magnétique ». Pourtant,
l’air que nous respirons à chaque instant consiste essentiellement
en un mélange de molécules de diazote, N2 et
de dioxygène, O2 (chaque molécule est constituée
de deux atomes d’azote N ou d’oxygène O). Ces molécules
sont «magnétiques», chacune à leur manière.
Les molécules de diazote sont «diamagnétiques»
: placées dans un champ magnétique intense elles sont très
faiblement repoussées. Les molécules de dioxygène
sont «paramagnétiques» : placées dans un champ
magnétique puissant elles sont faiblement attirées. Nous
expliquerons ces propriétés dans un instant, mais l’expérience
permet de les illustrer simplement : on plonge un aimant en U dans du
diazote liquide (a) ou dans du dioxygène liquide (b, c) et l’on
obtient les résultats de la figure 8.

Figure 8 : Propriétés magnétiques
des molécules composant l’air : a) le diazote liquide, diamagnétique,
ne se fixe pas sur les pôles de l’aimant permanent ; b) le
dioxygène liquide, paramagnétique, est attiré par
les pôles de l’aimant, il forme un cylindre liquide entre
les deux pôles ; c) à la température ambiante, le
dioxygène liquide s’évapore et le liquide restant
est attiré par l’un et l’autre pôle.
(montage
réalisé par S. Gao, université de Beijing).
Le monde
quantique
Dans tous les cas, solide, liquide ou molécule, le magnétisme
trouve son origine dans les propriétés magnétiques
de l’électron. Et l’on passe ici du monde macroscopique
au monde quantique, un monde très particulier, découvert
à la fin du XIXe siècle et au début du XXe siècle
et célébré récemment lors de l’année
mondiale de la physique 2005. Ce monde est quantifié ; la discontinuité
s’y substitue à la continuité du monde macroscopique.
C’est un monde aux règles bien établies, régi
par des nombres quantiques et des fonctions mathématiques qui dépendent
de ces nombres … C’est un monde où les dimensions deviennent
toutes petites, où le nanomètre (= 10-9
mètre = 1 mètre / 1000 000 000) remplace le mètre,
où la quantité de matière devient extrêmement
faible, un monde où la molécule se substitue à la
mole (une mole de molécules est constituée de 6,023 10+23
molécules, i.e. la constante d’Avogadro, un nombre difficilement
imaginable obtenu en multipliant vingt trois fois 10 par lui-même
…). C’est aussi un monde dont les concepts sont difficiles
à appréhender simplement mais qu’il est possible d’approcher
par des analogies, des modèles, des représentations …
C’est un monde que l’on peut considérer comme merveilleux,
plus merveilleux encore que le monde qu’Alice découvre aux
pays des merveilles.
L’électron
et ses propriétés magnétiques dans l’atome
L’électron présente de multiples visages : c’est
d’abord un corpuscule ayant une masse élémentaire,
une charge élémentaire négative, un moment magnétique
élémentaire (le magnéton de Bohr) ; c’est aussi
une onde, décrite par une fonction mathématique appelée
fonction d’onde, solution d’une équation proposée
par Erwin Schrödinger, l’équation de Schrödinger.
Dans un atome, où les électrons à charge négative
« tournent » autour du noyau chargé positivement, à
chaque fonction d’onde ou orbitale, est associée une énergie
correspondant à un état stationnaire de l’atome. C’est
l’une des premières merveilles du monde quantique qui permet
à deux charges de signe opposé de coexister de manière
stable au lieu de se précipiter l’une sur l’autre comme
dans notre monde classique … L’existence de l’atome
stable est fondée sur cette propriété.
La description quantique de l’électron repose sur quatre
nombres qui quantifient ses propriétés. L’année
de la physique 2005 a popularisé ces notions et nous n’y
revenons pas. Le nombre quantique de spin est égal à s =
½. Le moment magnétique correspondant – qu’il
est commode d’associer à un mouvement de rotation du spin
sur lui-même dans un sens ou dans le sens opposé (to spin
signifie tourner sur soi-même, en anglais) - est orienté
vers le haut (up,  ) pour ms =
+ ½ ou vers le bas (down, ) pour ms =
+ ½ ou vers le bas (down, ),
ms = - ½. En première approximation, on peut considérer
que ce moment est égal au magnéton de Bohr, µB. ),
ms = - ½. En première approximation, on peut considérer
que ce moment est égal au magnéton de Bohr, µB.
Pour « occuper » les orbitales, la mécanique quantique
a un ensemble de règles qu’on peut essayer d’exprimer
simplement : pas plus de deux électrons par orbitale (principe
de Pauli) et quand il y a deux électrons, ils sont de moments magnétiques
opposés. C’est une paire d’électrons (figure
9).

Figure
9 : Occupation d’une orbitale atomique par les électrons :
niveau simplement occupé, « up » pour ms = + ½
, « down » pour ms = - ½ et niveau doublement occupé.
Les niveaux
d’énergie correspondant aux orbitales se peuplent à
partir des niveaux les plus stables (principe de construction, on commence
toujours par le bas !). Quand plusieurs niveaux ont même énergie,
l’état qui est le plus stable est celui de plus haut spin
dit le principe de Hund (figure 10). Ce phénomène est dû
ici à l’orthogonalité des orbitales. Leur recouvrement,
définie par une intégrale mathématique, est strictement
nul.
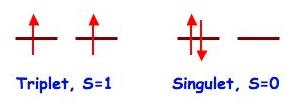
Figure 10 : comment deux électrons occupent-ils
deux orbitales orthogonales (qui ne se recouvrent pas) de même énergie
? Le principe de Hund répond que l’état le plus stable
est l’état de plus haut spin, le triplet, S=1.
Nous oublions
dans cette approche très simplifiée à la fois le magnétisme
dû au mouvement orbital des électrons autour du noyau et le
magnétisme du noyau lui-même, pourtant si important en imagerie
médicale.
Les électrons
dans les molécules
Une molécule est l’assemblage de plusieurs atomes. Les fonctions
d’onde décrivant les électrons dans les molécules
peuvent être représentées comme des combinaisons linéaires
d’orbitales atomiques (OA). Ce sont les orbitales moléculaires
(OM). Il y a autant d’orbitales moléculaires que d’orbitales
atomiques initiales …). Et les règles d’occupation
par les électrons sont les mêmes.
Molécule de dihydrogène et de diazote (diamagnétiques)
et de dioxygène (paramagnétique)
La molécule de dihydrogène est constituée de deux
atomes d’hydrogène dont les orbitales se combinent en phase
et en opposition de phase avec un recouvrement axial ( )
pour donner deux orbitales moléculaires (figure 11). Les deux électrons
s’apparient up et down, dans l’orbitale la plus basse en énergie.
La molécule est diamagnétique. )
pour donner deux orbitales moléculaires (figure 11). Les deux électrons
s’apparient up et down, dans l’orbitale la plus basse en énergie.
La molécule est diamagnétique.
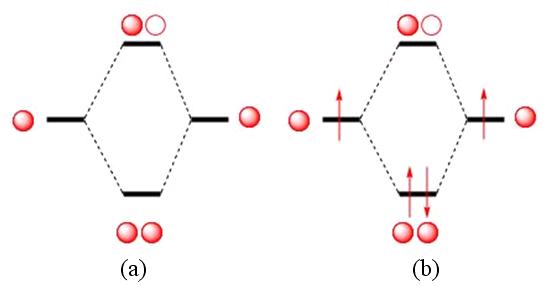
Figure 11 : Formation d’une molécule de
dihydrogène : (a) combinaison des orbitales atomiques ;
(b) appariement
des spins dans l’orbitale moléculaire stable, « liante
».
La molécule
de diazote est également diamagnétique. Tous ses électrons
sont appariés comme le montre la figure 12 pour les orbitales moléculaires
formées par recouvrement latéral des orbitales p ( ).
L’occupation des quatre orbitales moléculaires ).
L’occupation des quatre orbitales moléculaires  de
molécules analogues (figure 12) permet aussi de démontrer
le paramagnétisme du monoxyde d’azote (c) (spin = ½),
du dioxygène avec deux électrons célibataires dans
deux orbitales orthogonales, suivant le principe de Hund (d) (S = 1, triplet).
Ces schémas d’orbitales moléculaires expliquent simplement
les propriétés magnétiques du diazote et du dioxygène
(montrées expérimentalement en figure 8). de
molécules analogues (figure 12) permet aussi de démontrer
le paramagnétisme du monoxyde d’azote (c) (spin = ½),
du dioxygène avec deux électrons célibataires dans
deux orbitales orthogonales, suivant le principe de Hund (d) (S = 1, triplet).
Ces schémas d’orbitales moléculaires expliquent simplement
les propriétés magnétiques du diazote et du dioxygène
(montrées expérimentalement en figure 8).
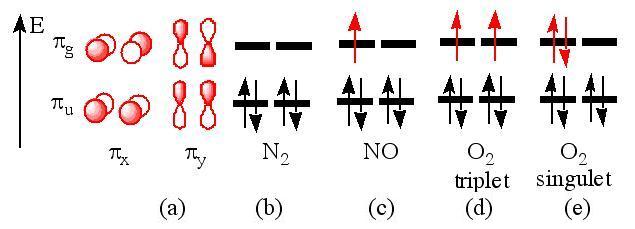
Figure 12 : Occupation des orbitales dites 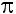 (a);
(a);
du diazote (b); du monoxyde d’azote (c) ;du dioxygène
triplet (d) ; du dioxygène singulet (e).
Cette situation
nous conduit à une observation d’intérêt très
général. L’air que nous respirons est essentiellement
constitué de molécules de diazote et de molécules
de dioxygène. Le diazote est une molécule particulièrement
stable, diamagnétique, et ne réagit pratiquement pas. Mais
autour de nous, l’oxygène est lié à pratiquement
tous les autres éléments chimiques. Avec l’hydrogène,
il forme de l’eau, H2O, avec le carbone, les hydrocarbures ou les
sucres, il forme le dioxyde de carbone et de l’eau. Avec les métaux,
il forme les oxydes. Pourtant les êtres vivants, végétaux
ou animaux, baignent dans une atmosphère de dioxygène sans
réagir violemment (heureusement, sinon nous serions réduits
à un peu de dioxyde de carbone, d’eau, de phosphates et d’oxydes
métalliques, état thermodynamiquement stable des composantes
du corps humain). Au contraire, dans les poumons, le dioxygène
se fixe sur l’hémoglobine. Il est le comburant des réactions
lentes d’oxydation au niveau des muscles et des tissus. Nous devons
cette situation au fait que le dioxygène est paramagnétique
et que ses réactions avec des composés diamagnétiques
sont lentes. Elles ne se produisent qu’en chauffant, dans une flamme
ou grâce à des machines moléculaires complexes comme
l´hémoglobine. Nous n’existons donc, loin de la situation
d’équilibre thermodynamique que grâce aux propriétés
magnétiques du dioxygène …
Que se passe-t-il quand deux électrons du dioxygène se placent
dans une même orbitale (Figure 12e) ? Le dioxygène singulet
est une espèce excitée qui est produite notamment par la
réaction chimique de l’eau oxygénée, H2O2,
avec des oxydants en milieu basique. Une fois produit, le dioxygène
singulet peut se désexciter pour redonner le dioxygène triplet,
avec émission d’une belle lumière rouge ou bien réagir
avec d’autres molécules qui peuvent à leur tour émettre
de la lumière. C’est le cas du luminol et d’autres
molécules luminescentes, comme le montre la figure 13. La lumière
émise par le ver luisant, rencontré en été
au creux des chemins, est produite par cette réaction. De manière
plus prosaïque, les marchands de matériel de camping vendent
des bâtons lumineux de diverses couleurs et de diverses intensités
lumineuses comme sources de lumière de secours. Les colliers lumineux
utilisés lors des soirées dansantes de l’été
sont basés sur le même phénomène. La réactivité
du dioxygène à l’état singulet est ainsi complètement
différente de celle du dioxygène triplet.
O2 singulet (excité) ==> O2 triplet (stable)
+ énergie lumineuse (rouge)
O2 singulet + luminol ==> Espèces excitées
du luminol ==> lumière

Figure 13 : Réactivité du dioxygène
singulet : produit au cours d’une réaction chimiluminescente,
il peut réagir avec des molécules comme le luminol (a) dont
les états excités (b) se désexcitent en émettant
de la lumière (c).
Radicaux
moléculaires
La molécule de monoxyde de carbone NO (figure 12c) est un exemple
de radical moléculaire stable : une molécule portant un
spin S=1/2. Il y a bien d’autres exemples. Par exemple NO peut réagir
avec le dioxygène pour donner le dioxyde d’azote NO2,
également paramagnétique (figure 14c). De nombreuses molécules
organiques appartiennent à cette catégorie, par exemple
les radicaux nitronylnitroxydes (figure 14d). Dans tous les cas, l’électron
célibataire se situe dans une orbitale « frontière
», haute en énergie non liante ou antiliante : les électrons
« magnétiques » ne participent pas aux liaisons et
à la stabilité de la molécule.
Figure 14 : Quelques
molécules radicalaires paramagnétiques et les orbitales
moléculaires occupées par un seul électron :
(a) niveau simplement occupé ; (b) NO• ; (c)NO2•
; (d) nitronylnitroxyde•.
Nous pouvons
désormais aborder le sujet essentiel de notre propos : comment
les chimistes, connaissant les règles qui régissent l’interaction
entre électrons peuvent manipuler les spins des molécules
pour obtenir les matériaux magnétiques qu’ils souhaitent
? On comprend que cela ne soit pas si simple car il faut à la fois
obtenir des molécules stables, donc former des liaisons solides
et garder des électrons célibataires « magnétiques
» et contrôler les interactions entre eux, qui sont très
faibles (figure 15) ! Si l’on utilise les électrons célibataires
pour former des liaisons, on obtient des composés diamagnétiques
! C’est ce qui se passe lorsque l’on fait réagir deux
molécules de dioxyde d’azote NO2 entre elles.
Chacune porte un électron. La molécule N2O4
qui se forme est diamagnétique. On peut facilement visualiser cette
réaction car le dioxyde d’azote est brun (on le connaît
souvent sous le nom de vapeurs rousses) et la molécule dimère
est incolore. La réaction, qui dégage de la chaleur, est
facilement réalisée en baissant la température (figure
16). Elle est réversible : quand on réchauffe, on retrouve
les vapeurs rousses de dioxyde d’azote.
Figure 15 : Le dilemme à résoudre : former
des liaisons solides avec des électrons organisés en paires
diamagnétiques et sauvegarder des électrons célibataires,
en contrôlant l’interaction très faible entre eux (avec
les images d’un lien familial fort et de Michel-Ange – Chapelle
Sixtine, Rome).
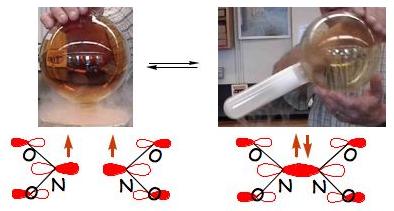
Figure 16 : La réaction de dimérisation
du dioxyde d’azote paramagnétique NO2,
brun, à gauche, est favorisée à basse température.
Elle conduit à la formation d’une molécule diamagnétique,
N2O4
incolore, à droite. Sous les photographies, est indiquée
l’interprétation orbitale de la formation de la liaison.
Les complexes des éléments de transition
Les éléments de transition sont les éléments
de la classification périodique (Figure 17) qui possèdent
des orbitales d partiellement occupées par des électrons.
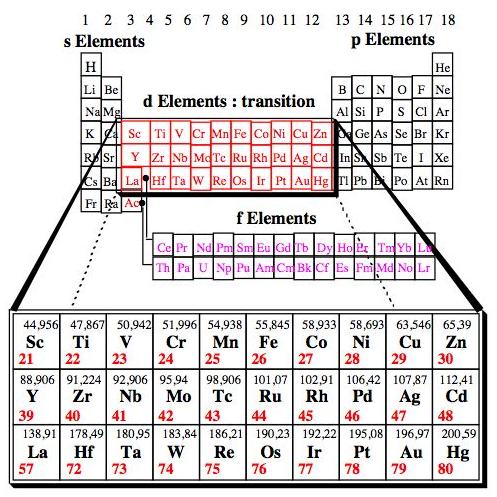
Figure
17 : Classification périodique des éléments mettant
en évidence les colonnes 1 à 18,
les éléments
s et p et les éléments de transition d
Il y a cinq
orbitales d (caractérisées par le nombre quantique l=2),
ce qui permet d’obtenir des spins de S=0 à S=5/2 : l’ion
manganèse(II), Mn2+ ou Mn(II), l’ion ferrique,
Fe3+ ou Fe(III) ont un spin S=5/2 (figure 18). D’autres
éléments, les lanthanides, présentent des orbitales
f partiellement occupées au nombre de sept (l =3) et l’on
peut obtenir ainsi un spin S=7/2, avec l'ion gadolinium(III), Gd3+
ou Gd(III). Dans un ion de transition isolé, les orbitales d ont
la même énergie. On dit qu’elles ont dégénérées.
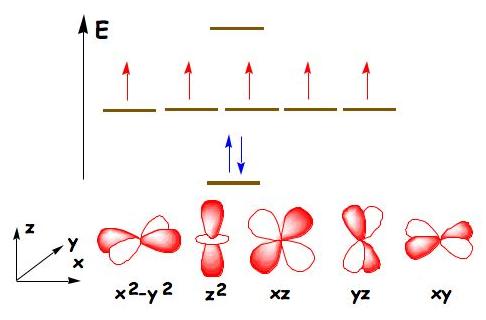
Figure 18 : Les orbitales d des éléments de transition sont
à l’origine des propriétés magnétiques,
électriques et optiques de ces éléments et de leurs
composés. Elles sont de symétrie paire (g). L’exemple
correspond à un ion Mn(II) ou Fer(III), spin S= 5/2.
Les ions de
transition peuvent s’entourer de molécules que l’on
appelle pour la circonstance des ligands (qui se lient, du latin ligare)
pour former des molécules plus grandes, appelées des complexes
métalliques. L’interaction électrostatique avec les
liaisons qui se créent entre l’ion et les ligands est appelée
« champ des ligands ». La théorie du champ des ligands
est une application extrêmement riche et utile de la mécanique
quantique et de la théorie de la symétrie à l’étude
de ces complexes. Pour notre propos, il suffit de savoir que l’approche
des ligands modifie l’énergie des orbitales métalliques
de manière différenciée et que se forment des orbitales
moléculaires par combinaison des orbitales du métal et des
ligands … Les électrons célibataires se distribuent
dans les nouveaux niveaux d’énergie ainsi créés.
Pour un complexe octaédrique ML6 où les ligands L forment
un octaèdre autour de l’ion métallique M, les orbitales
se scindent en deux groupes appelés t2g et eg
selon des appellations de la théorie de la symétrie (figures
19 et 20).
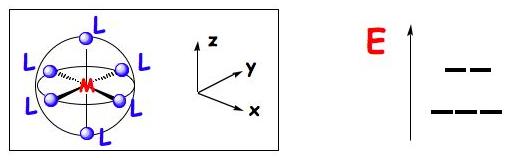
Figure 19 : Modification de l’énergie des niveaux d par un
champ des ligands octaédrique.
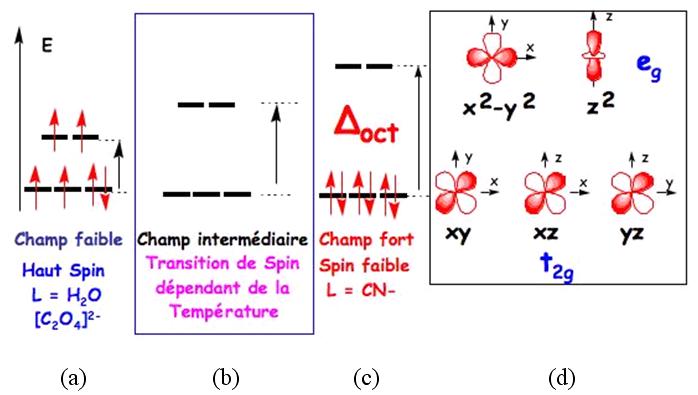
Figure 20 : Orbitales d, t2g et eg (en d) ; variation
du champ des ligands avec la nature des ligands et influence sur les propriétés
magnétiques (a-c).
L’écart
en énergie entre les niveaux t2g et eg ,
appelé  , dépend
de la nature des ligands. , dépend
de la nature des ligands.
La distribution
des électrons dans les niveaux est appelée configuration
électronique. L’occupation des orbitales dépend de
la nature des ligands et de l’importance du champ des ligands. La
figure 20 montre les deux manières de distribuer les électrons
dans les orbitales des complexes octaédriques de l’ion fer(II),
avec six électrons dans les orbitales d, d6. Dans un
champ des ligands  faible,
dans l’ion hexaaqua fer(II) [Fe(II)(H2O)6]2+par
exemple (fig. 20a), les cinq premiers électrons occupent d’abord
tous les niveaux disponibles et le sixième électron s’apparie
dans une des orbitales t2g. On obtient un spin S=2 (spin fort
ou haut spin). Si l’on remplace l’eau par l’ion cyanure
CN- , lié par le carbone, on obtient un complexe hexacyanoferrate(II),
[Fe(II)(CN)6 ]4-, où le champ des ligands
est très fort, faible,
dans l’ion hexaaqua fer(II) [Fe(II)(H2O)6]2+par
exemple (fig. 20a), les cinq premiers électrons occupent d’abord
tous les niveaux disponibles et le sixième électron s’apparie
dans une des orbitales t2g. On obtient un spin S=2 (spin fort
ou haut spin). Si l’on remplace l’eau par l’ion cyanure
CN- , lié par le carbone, on obtient un complexe hexacyanoferrate(II),
[Fe(II)(CN)6 ]4-, où le champ des ligands
est très fort,  est très important et dès le quatrième électron,
les électrons s’apparient dans les orbitales les plus basses
en énergie (fig. 20c). Tous les électrons sont appariés.
Le spin du complexe est S=0 (spin faible ou bas spin). En enlevant un
électron, on obtiendrait un ion fer(III) trivalent, avec cinq électrons
dans les orbitales d, d5. En champ faible, dans [Fe(H2O)6]3+
par exemple, le spin est 5/2 et en champ fort, [Fe(III)(CN)6
]3-, le spin est ½. Lorsque le champ des ligands est
intermédiaire, intervient une situation extrêmement intéressante
où la population des orbitales peut varier en fonction de la température
ou de la pression … ce qui donne lieu au phénomène
de transition de spin.
est très important et dès le quatrième électron,
les électrons s’apparient dans les orbitales les plus basses
en énergie (fig. 20c). Tous les électrons sont appariés.
Le spin du complexe est S=0 (spin faible ou bas spin). En enlevant un
électron, on obtiendrait un ion fer(III) trivalent, avec cinq électrons
dans les orbitales d, d5. En champ faible, dans [Fe(H2O)6]3+
par exemple, le spin est 5/2 et en champ fort, [Fe(III)(CN)6
]3-, le spin est ½. Lorsque le champ des ligands est
intermédiaire, intervient une situation extrêmement intéressante
où la population des orbitales peut varier en fonction de la température
ou de la pression … ce qui donne lieu au phénomène
de transition de spin.
Les couleurs
des complexes des éléments de transition
La couleur des
complexes dans l’eau (figure 21) est une des manifestations de la
présence du champ des ligands, qui varie avec les ions métalliques.
La couleur des solutions reflète l’écart en énergie
entre les orbitales t2g et eg et, très exactement, la différence
d’énergie entre les deux configurations a) et b) de la figure
(figure 22) :
a) état fondamental ; b) état excité par l’absorption
d’un photon hv. Les couleurs ne sont pas très intenses car
les transitions sont interdites par la symétrie. Les transitions
qui exigent un renversement du spin [cas du Mn(II)] sont aussi interdites
de spin et deviennent extrêmement faibles comme le montre la couleur
très peu intense d’une solution de Mn(II). En outre, la solution
d’ions zinc(II) est incolore car toutes les orbitales d sont occupées
(configuration électronique d10).

Figure 21 : Variation de la couleur de solutions aqueuses d’ions divalents
de la première ligne des éléments de transition de
la classification périodique, du vanadium(II) au zinc(II). La couleur
varie avec le nombre d’électrons dans les orbitales d. Les
couleurs sont peu intenses car les transitions entre orbitales d dans un
complexe octaédrique sont « interdites ».
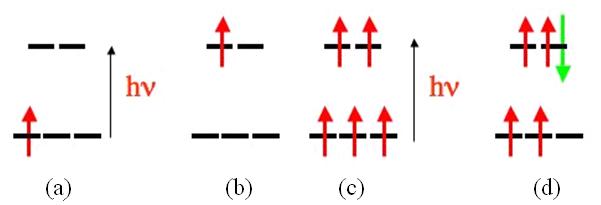
Figure 22 : Schémas de transitions électroniques
entre orbitales d des complexes d’éléments de transition
: état fondamental d’un complexe d1 ; (b) état excité
après absorption d’un photon, sans changement de spin : (c)
état fondamental d’un complexe d5 ; (d) état excité
après absorption d’un photon : il a été nécessaire
de renverser un spin, la transition est fortement interdite. Observer la
couleur très pâle de la solution de manganèse(II) sur
la figure 21.
Les propriétés
magnétiques des complexes des éléments de transition
Il est évidemment
possible de mesurer le magnétisme d’une substance avec des
balances ou des instruments plus complexes, susceptomètres ou magnétomètres.
La figure 23a montre la balance magnétique conçue et utilisée
par Pierre Curie. On peut avoir une idée du nombre d’électrons
célibataires d’un complexe métallique de manière
plus simple avec le dispositif de la figure 23b. On approche une capsule
contenant l’échantillon d’un aimant : l’échantillon
est d’autant plus fortement attiré que le nombre d’electrons
célibataires est plus grand.
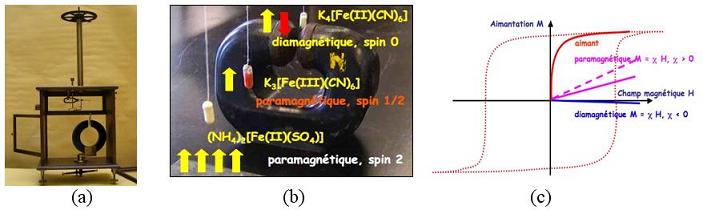
Figure 23 : a) balance magnétique de Pierre
Curie (collection de physique, Université Pierre et Marie Curie)
; (b) aimant permanent et échantillons pour montrer que l’aimantation
dépend du nombre d’électrons dans des complexes para-
ou dia-magnétiques (R. Thompson, Université de British Columbia,
Vancouver) ; (c) courbes d’aimantation pour des composés
diamagnétique, paramagnétiques, et un aimant.
La manière
dont les corps s’aimantent s’appelle l’aimantation M.
Dans les cas simples, elle est proportionnelle au champ magnétique
appliqué H. La constante de proportionnalité, pour une mole
de matière, s’appelle la susceptibilité magnétique
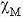
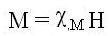 [1]
[1]
Les substances
diamagnétiques ont une susceptibilité magnétique
très faible et négative, due aux électrons appariés.
Dans les cas très simples de composés paramagnétiques,
la susceptibilité magnétique 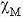 dépend
du nombre n d’électrons célibataires dans une molécule
du composé de la manière, donnée par la loi établie
par Pierre Curie (et connue sous le nom de loi de Curie) que l’on
peut écrire : dépend
du nombre n d’électrons célibataires dans une molécule
du composé de la manière, donnée par la loi établie
par Pierre Curie (et connue sous le nom de loi de Curie) que l’on
peut écrire :
 [2] [2]
Avec le système
d’unités utilisé ici (dit uem-cgs), la susceptibilité
est exprimée en cm3 mol-1.
Ainsi, sur la figure 23, un échantillon de fer(II) bas spin, contenant
[Fe(II)(CN)6 ]4-, S=0, où tous les électrons
sont appariés, est faiblement repoussé (figure 23c, courbe
bleue). Un échantillon de fer(III), contenant [Fe(III)(CN)6
]3-, S=1/2, avec un seul électron célibataire
est moins attiré qu’un échantillon de fer(II) haut
spin, contenant [Fe(II)(H2O)6]2+, S =2,
avec 4 électrons célibataires (figure 23c, courbes violettes
de pente différente). On observe aussi le comportement d’un
aimant « dur » (courbe rouge) qui n’obéit pas
à la loi de Curie. La pente de la courbe de première aimantation
est très élevée puis on obtient un cycle d’hystérésis
(du grec husterein, être en retard) quand on fait varier le champ
autour de la valeur zéro avec une forte aimantation rémanente
(à champ nul) et un fort champ coercitif (champ où l’on
retrouve une aimantation nulle). On observe qu’à champ nul,
le système est bistable, l’aimantation peut être positive
ou négative. Le système a une mémoire et peut être
utilisé pour stocker de l’information …
Comment
les chimistes peuvent et savent varier les propriétés magnétiques
?
On peut changer
les propriétés magnétiques des complexes des éléments
de transition, simplement en variant les ligands autour de l’ion métallique.
Une expérience simple illustrant la flexibilité de cette chimie
est montrée sur la figure 24 : il est possible simplement de changer
les ligands, la couleur, la géométrie.
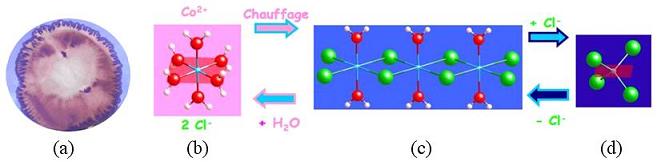
Figure 24 : Flexibilité de l’environnement
(sphère de coordination) des ions de transition, cas d’un
complexe de cobalt(II) :
(a) Expérience ; (b-c) transformations
de l’environnement de l’ion cobalt.
Changement
de ligands et de géométrie
Un papier-filtre est imprégné d’une solution concentrée
de chlorure de cobalt, CoCl2, 6H2O : le papier devient
rose pâle [Co(II)(H2O)6]2+ (figure 24b). Le
papier est alors chauffé à l’aide d’un générateur
d’air chaud (sèche-cheveux…). Le papier sec devient
bleu clair. Il se forme la chaîne de la figure 24c où deux
ions chlorure Cl- relient deux ions cobalt. Deux molécules d’eau
restent au-dessus et au-dessous du ruban de la chaîne. Cette réaction
chimique est parfois utilisée pour donner une indication sommaire
du degré hygrométrique d’une atmosphère. Le
phénomène est en effet réversible : l’addition
de quelques gouttes d’eau (ou une atmosphère humide) permet
de revenir à la couleur rose. Cependant, on observe aussi la formation
d’une autre espèce bleu violet intense tétraédrique,
[Co(II)(Cl)4]2- sur les parties du papier où s’accumulent
les ions chlorure. La couleur est plus intense parce que le tétraèdre
ne présente pas de centre d’inversion et que les transitions
électroniques deviennent permises par symétrie (figure 24d).
On observe la couleur bleu foncé à la limite des zones rose
et bleu clair, où s’accumulent les ions chlorure. Cependant,
dans cette suite de réactions, le spin des complexes est resté
le même.
Changements
de spin
Il en va différemment dans ce qui suit (expérience de la
figure 25). Dans une boîte de Petri en verre transparent (pour pouvoir
projeter sur un rétroprojecteur), on place une solution diluée
de sel de Mohr qui contient l’espèce octaédrique [Fe(II)(H2O)6]2+,
spin S=2.
On ajoute alors
une goutte ou deux d’une solution dans l’alcool (éthanol)
d’orthophénantroline (o-phen) une molécule organique
possédant deux atomes d’azote susceptible de se lier à
l’ion fer(II). On observe immédiatement une intense coloration
rouge due au complexe [Fe(II)(o-phen)3]2+ représenté
sur la figure 25. Le champ des ligands des trois molécules d’ortho-phénantroline
est fort et le nouveau complexe a un spin faible, S=0. On remarque (figure
25b) que les trois molécules d’ortho-phénantroline
forment une hélice, qui peut tourner à droite ou à
gauche : les deux hélices ne sont pas superposables – comme
deux mains, droite et gauche - : ces complexes sont chiraux.
Figure 25 : (a) Contrôle du magnétisme
(état de spin) d’un complexe métallique de fer(II)
à l’aide des ligands : du haut spin à bas spin en
substituant des molécules d’eau (complexe vert clair) par
des molécules d’ortho-phénantroline (complexe rouge)
; (b) les complexes formés sont un mélange d’espèces
chirales ; (c) à l’image de P. Langevin, le chimiste joint
l’action à la pensée : ayant compris la nature du
champ des ligands, il agit pour changer les propriétés (Paul
Langevin, La pensée et l’action, Editions Sociales, Paris).
Les complexes
à transition de spin : du quantique au démonstrateur
L’immensité
du choix de ligands permis par la chimie organique autorise de réaliser
une situation intermédiaire où le champ des ligands présente
une valeur moyenne : certains complexes sont haut spin à haute
température et deviennent bas spin à basse température.
Et ils changent de couleur avec le champ des ligands ! La figure 26a représente
la structure schématique d’une chaîne d’ions
fer(II) liés par trois molécules neutres de triazole substituées
par un groupement R. L’unité de base de la chaîne porte
les deux charges positives de l’ion fer(II). Des ions négatifs
(anions) se placent entre les chaînes et assurent l’électroneutralité
du composé. A haute température, le composé est blanc
et haut spin (S=2) ; à basse température, le complexe est
rouge bordeaux et bas spin (S=0). Quand le chimiste varie les conditions
de synthèse, les substituants R et les anions, il est possible
d’obtenir la courbe de susceptibilité de la figure 26b (on
peut vérifier les valeurs de 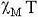 pour n = 0 et 2 grâce à la formule [2] …). L’important
ici est non seulement le passage de la forme haut spin HS à la
forme bas spin BS (BS<==HS) quand on descend en température
aux environs de la température ambiante (300K) et inversement (BS==>HS)
quand on monte en température, mais le fait que la température
de transition est différente
pour n = 0 et 2 grâce à la formule [2] …). L’important
ici est non seulement le passage de la forme haut spin HS à la
forme bas spin BS (BS<==HS) quand on descend en température
aux environs de la température ambiante (300K) et inversement (BS==>HS)
quand on monte en température, mais le fait que la température
de transition est différente  .
Ce phénomène est appelé « hystérésis
». Il est dû à l’interaction entre les chaînes
dans la structure. Il est à la source d’une importante propriété
du système que l’on appelle la bistabilité : à
une température comprise entre .
Ce phénomène est appelé « hystérésis
». Il est dû à l’interaction entre les chaînes
dans la structure. Il est à la source d’une importante propriété
du système que l’on appelle la bistabilité : à
une température comprise entre ,
le système peut être haut spin ou bas spin, blanc quand il
vient des hautes températures ou rouge quand il vient des basses
températures : il se « rappelle » son passé
thermique, il a une « mémoire ». Cette propriété
peut être utilisé dans les démonstrateurs d’affichage
montrés sur la figure 26b. Des éléments chauffants
(par effet Joule) ou réfrigérants (par effet Peltier) permettent
l’affichage de plots de couleur différente utilisés
dans l’affichage (panneaux d’affichage, carte téléphonique…). ,
le système peut être haut spin ou bas spin, blanc quand il
vient des hautes températures ou rouge quand il vient des basses
températures : il se « rappelle » son passé
thermique, il a une « mémoire ». Cette propriété
peut être utilisé dans les démonstrateurs d’affichage
montrés sur la figure 26b. Des éléments chauffants
(par effet Joule) ou réfrigérants (par effet Peltier) permettent
l’affichage de plots de couleur différente utilisés
dans l’affichage (panneaux d’affichage, carte téléphonique…).
Cet exemple montre le passage de l’utilisation de la mécanique
quantique et de la thermodymanique aux propriétés physiques
et aux applications.
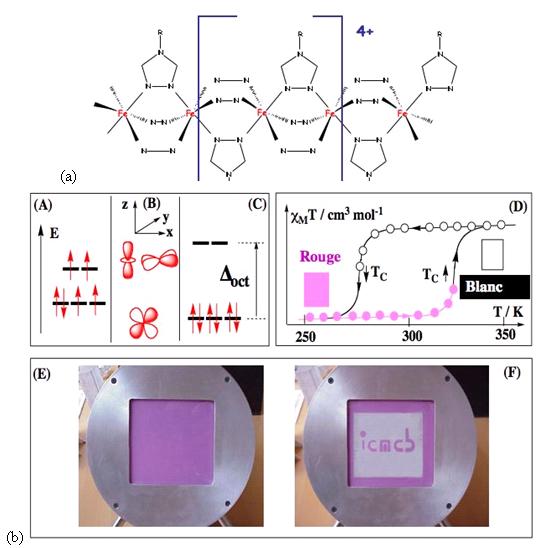
Figure 26 : (a) Structure schématique de la
chaîne de fer(II) à ponts triazole, à transition de
spin ;
(b) du quantique au dispositif : (A-C) orbitales et états
de spin du fer(II) ;
(D) courbe de susceptibilité magnétique
et bistabilité du système ;
(E-F) dispositif d’affichage
(J.F. Letard, ICMC Bordeaux)
Interaction
entre électrons sur des centres voisins : de la molécule
à l’aimant
Spins
parallèles ou antiparallèles : comment ?
Jusqu’à présent, nous n’avons évoqué
que des exemples où les propriétés ne dépendaient
que d’ions de transition isolés. Même quand nous avons
évoqué des chaînes, les propriétés magnétiques
ne reposaient pas essentiellement sur l'interaction avec les électrons
sur des sites voisins. Nous franchissons donc un pas nouveau dans la complexité
en abordant l’interaction d’échange, qui est une interaction
électrostatique, quantique, entre deux électrons portés
sur des sites voisins. Une fois encore, nous devons simplifier beaucoup.
Nous devons, de fait, trouver le moyen de maîtriser l’interaction
pour que deux électrons sur des centres voisins aient leurs spins
soit parallèles 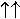 (situation
de triplet. S=1), soit antiparallèles (situation
de triplet. S=1), soit antiparallèles  (situation de singulet, S=0) ! Lorsque les électrons sont localisés,
quand ils n’ont pas tendance à sauter d’un centre à
un autre, la situation peut être résumée par la figure
27. La différence entre l’énergie du singulet ES
et celle du triplet ET est la constante de couplage entre les
spins. On l’appelle J (= ES -ET). Si l’on
veut que le triplet soit l’état fondamental, J doit être
positif. On dit alors que le couplage est ferromagnétique. Si l’on
veut que le singulet soit l’état fondamental, J doit être
négatif. On dit que le couplage est antiferromagnétique.
A cette « stratégie de spin » correspond une «
stratégie orbitale » que nous avons déjà entr’aperçue
: le recouvrement de deux fonctions d’onde conduit à la formation
de paire d’électrons (couplage antiferromagnétique,
dihydrogène), l’orthogonalité de deux fonctions d’onde
conduit au couplage ferromagnétique (dioxygène). Il suffit
de généraliser comme l’indiquent les schémas
des orbitales de la figure 27. Il existe bien sûr des formules et
des modèles quantiques pour rendre cette démonstration quantitative,
mais l’approche qualitative est ici suffisante. La stratégie
orbitale peut alors déboucher sur le choix de structure et de structure
électronique des composants, c’est-à-dire sur une
« stratégie chimique ».
(situation de singulet, S=0) ! Lorsque les électrons sont localisés,
quand ils n’ont pas tendance à sauter d’un centre à
un autre, la situation peut être résumée par la figure
27. La différence entre l’énergie du singulet ES
et celle du triplet ET est la constante de couplage entre les
spins. On l’appelle J (= ES -ET). Si l’on
veut que le triplet soit l’état fondamental, J doit être
positif. On dit alors que le couplage est ferromagnétique. Si l’on
veut que le singulet soit l’état fondamental, J doit être
négatif. On dit que le couplage est antiferromagnétique.
A cette « stratégie de spin » correspond une «
stratégie orbitale » que nous avons déjà entr’aperçue
: le recouvrement de deux fonctions d’onde conduit à la formation
de paire d’électrons (couplage antiferromagnétique,
dihydrogène), l’orthogonalité de deux fonctions d’onde
conduit au couplage ferromagnétique (dioxygène). Il suffit
de généraliser comme l’indiquent les schémas
des orbitales de la figure 27. Il existe bien sûr des formules et
des modèles quantiques pour rendre cette démonstration quantitative,
mais l’approche qualitative est ici suffisante. La stratégie
orbitale peut alors déboucher sur le choix de structure et de structure
électronique des composants, c’est-à-dire sur une
« stratégie chimique ».
Figure
27 : Stratégie de spin et stratégie orbitale : le ferromagnétisme
naît de l’orthogonalité des orbitales
et l’antiferromagnétisme
provient du recouvrement.
Il est également
important de contrôler la valeur de la constante J : le couplage entre
ions métalliques libres, sans ligand en pont, serait très
faible car les fonctions d’onde décroissent très rapidement.
Les ligands pontants jouent donc un très grand rôle. La figure
28a montre le recouvrement entre deux orbitales d permis par un ligand et
la figure 28b montre un ion pontant cyanure, CN- , dissymétrique,
entre deux ions métalliques différents. La figure 29 montre
la structure et la structure électronique d’un précurseur
très utile de matériaux moléculaires magnétiques,
un hexacyanochromate. Attention : les ions cyanure peuvent être dangereux
par ingestion ou parce qu’ils peuvent donner du cyanure d’hydrogène
HCN, gazeux et très toxique. Il faut les manipuler avec précaution.
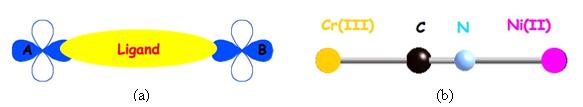
Figure 28 : (a) Rôle du ligand dans l’interaction
; (b) un exemple de pont linéaire court et dissymétrique,
l’ion cyanure.
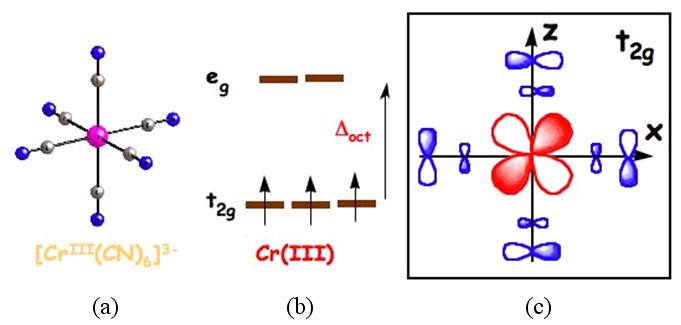
Figure 29 : Structure électronique d’un
complexe et rôle du ligand : dans le complexe octaédrique
[Cr(III)(CN)6 ]3- (a), de spin S=3/2 (b), la fonction
d’onde autour de l’ion Cr(III) est très délocalisée
sur les ions cyanure (c).
Comment
obtenir des molécules à spin élevé ?
Il convient de combiner la stratégie chimique (complexes comportant
de nombreux métaux, ou polynucléaires : figure 30), la stratégie
de spin (comment a priori combiner les spins ? figure 31), et la stratégie
orbitale (pour réaliser les interactions souhaitées).
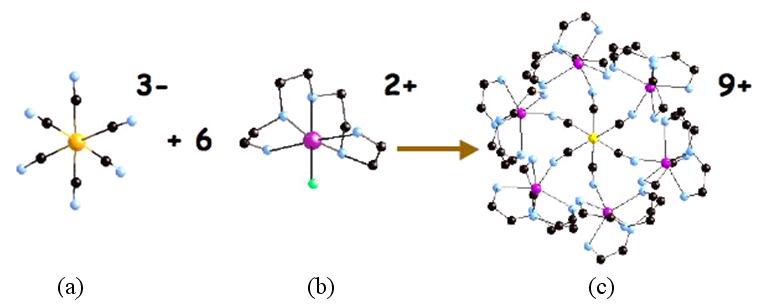
Figure 30 : Stratégie chimique : réaction
acide-base pour construire des molécules complexes La réaction
de précurseurs simples
[Cr(III)(CN)6 ]3-,
spin 3/2 (a) et ML2+ (spin variable) (b) donne une molécule
sphérique [Cr(III)(CN- ML)6 ]9+,
en abrégé CrM6) (c).
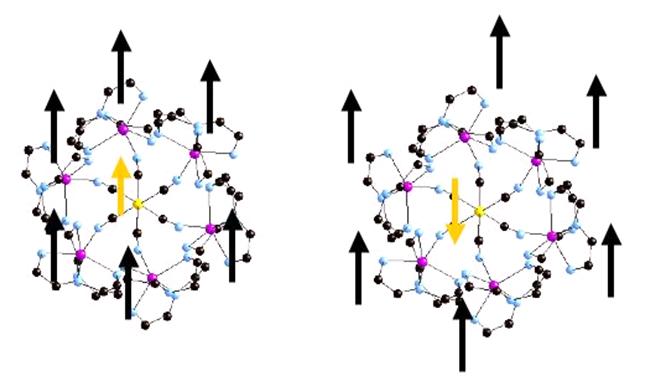
Figure 31 : Stratégie de spin : l’interaction
peut être ferromagnétique et tous les spins s’ajoutent
(SA+SB) ou antiferromagnétique et les spins
se retranchent(SA-SB).
Dans ce dernier cas, quand (SA SB),
le spin total est non nul et le système est dit ferrimagnétique
selon l’expression proposée par Louis Néel. SB),
le spin total est non nul et le système est dit ferrimagnétique
selon l’expression proposée par Louis Néel.
Les stratégies
chimique et de spin sont complétées par la stratégie
orbitale : l’orthogonalité crée le ferromagnétisme
; le recouvrement donne naissance à l’antiferromagnétisme.
Sans entrer dans le détail, quand dans une molécule CrM6,
on choisit un complexe du nickel(II) (spin 1) comme ion M(II), les orbitales
du chrome et du nickel sont orthogonales et le spin du complexe atteint
S= 15/2 = 6x1 + 3/2. Si on choisit un complexe du manganèse(II) (spin
5/2), trois des orbitales du chrome et du manganèse se recouvrent,
l’antiferromagnétisme l’emporte, le complexe est ferrimagnétique
et le spin du complexe, à basse température, atteint S= 27/2
= 6x5/2-3/2. S=15/2 ou 27/2 sont des valeurs qui n’existent pas
dans la classification périodique … où le maximum est
de 7/2 pour l’ion gadolinium(III) …
Vers
des aimants ferro- et ferri-magnétiques à précurseurs
moléculaires
Il est désormais possible d’étendre la démarche
utilisée de la molécule au solide et essayer d’obtenir
des températures d’ordre magnétique aussi élevées
que possible. Louis Néel, physicien français, Prix Nobel,
a proposé que la température de Curie Tc définie
plus haut était proportionnelle au nombre de voisins magnétiques
z et à la valeur absolue constante de couplage |J|,alors : 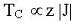 . .

Figure
32 : Formation du bleu de Prusse : (a) réaction chimique ; (b) Structure
; les octaèdres bleus sont les ions [Fe(II)(CN)6 ]4- et les sphères
jaunes les ions fer(III) ; (c) précipitation progressive dans une
boîte de Pétri, à partir de cristaux de ferrocyanure
de potassium et de chlorure ferrique(III) placés de part et d’autre
de la boîte puis recouverts d’eau. Le précipité
se forme là où les solutions entrent en contact par convexion.
Le bleu de
Prusse, mis en évidence pour la première fois comme pigment
à Berlin, en 1704 par un drapier berlinois du nom de Diesbach,
est souvent considéré comme le premier composé connu
de chimie de coordination. Il a une structure cubique (les faces des cubes
sont également occupées), il comporte des ions fer(II) et
fer(III), à deux degrés d’oxydation différents.
C’est un composé à valence mixte d’un bleu intense.
On le prépare aujourd’hui comme le montre la figure 32. C’est
un composé neutre qui compte trois complexes [Fe(II)(CN)6]4-
pour quatre ions fer(III) : [Fe(III)4[Fe(II)(CN)6]3]0.
Certains des sites correspondant aux ions ferrocyanure sont vacants et
se remplissent de molécules d’eau qui se fixent sur les ions
fer(III). Ces lacunes sont très importantes pour les propriétés.
Depuis 1704, le bleu de Prusse a fait une belle carrière comme
pigment chez les artistes peintres et ailleurs. On peut illustrer cet
aspect de sa chimie en réalisant des cyanotypes. Un papier photographique,
imprégné d’oxalate ferrique [Fe(III)(C2O4
)3]3- est recouvert d’un négatif de
l’image à reproduire et irradié à la lumière
blanche. Aux endroits irradiés, se produit une réaction
d’oxydoréduction interne qui transforme le fer(III) en fer(II)
et l’oxalate en dioxyde de carbone. On révèle l’image
latente, en faisant réagir du ferricyanure de potassium sur le
fer(II) formé au cours de l’irradiation (figure 33). Il se
forme du bleu de Prusse aux endroits irradiés.

Figure
33 : Préparation d’un cyanotype reproduisant une photographie
de Pierre et Marie le jour de leur mariage (original en provenance du
musée Curie) : irradiation du papier photographique, bains de révélation,
et production de l’image.
Les propriétés
magnétiques du composé sont moins exaltantes, c’est
un aimant ferromagnétique à la très basse température
de 5,6 Kelvins. Un des grands intérêts du bleu de Prusse
est sa structure à la fois très simple, cubique d’apparence
très rigide, mais de fait très flexible chimiquement : on
peut remplacer les ions fe(II) et fer(III) à volonté ou
presque et l'on obtient une grande famille d'analogues aux propriétés
très diverses. C’est cette flexibilité qui nous a
permis de choisir les bonnes paires d’éléments de
transition pour créer des interactions ferromagnétiques
ou antiferromagnétiques de plus en plus fortes entre voisins métalliques
(figure 34), pour obtenir un analogue dont la température de Curie
est supérieure à la température ambiante (figure
35).
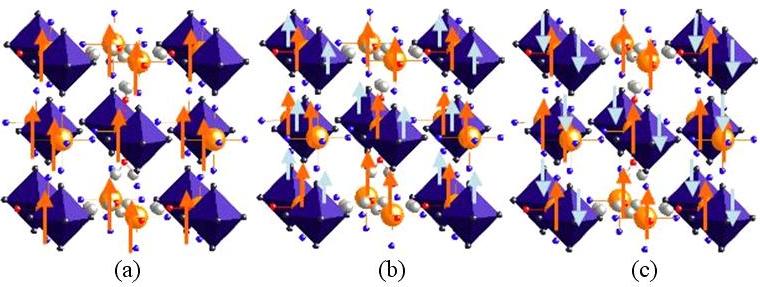
Figure 34 : Orientation des spins dans des analogues
du bleu de Prusse dans la phase magnétiquement ordonnée
: (a) bleu de Prusse lui-même en dessous de 5,6K ; (b) analogue
ferromagnétique : tous les spins sont parallèles ; (c) analogue
ferrimagnétique : les spins des plus proches voisins sont antiparallèles.
Si les spins voisins sont différents, le spin total est non nul.
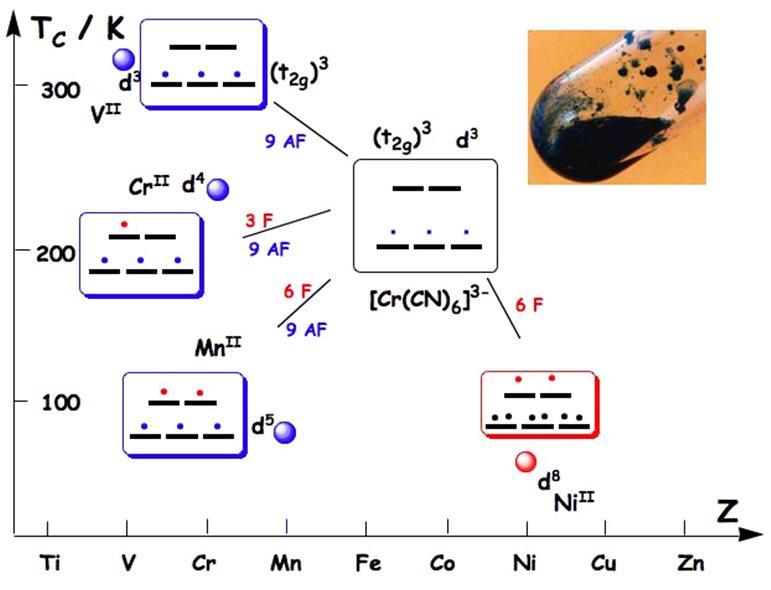
Figure 35 : Diagramme
montrant les températures de Curie Tc d’analogues magnétiques
du bleu de Prusse de type [A(II)4[Cr(III)(CN)6]8/3]
en fonction de la nature et du numéro atomique Z de l’ion
métallique A(II) et l’analyse schématique des interactions
en compétition (F, ferro, AF, antiferromagnétique). Le dérivé
[V(II)4[Cr(III)(CN)6 ]8/3 ]•nH2O
(VCr), est un aimant ferrimagnétique à la température
ambiante, d’un bleu profond, transparent, de faible densité
(comme le montre l’inséré).
Comme précédemment
avec les complexes à transition de spin, on peut utiliser les nouveaux
composés ainsi synthétisés pour des applications.
C’est ce qui est fait dans les trois démonstrateurs de la
figure 36, conçus et réalisés en collaboration avec
Gérard Keller (UFR de pharmacie, Université Paris-Sud, Chatenay-Malabry)
et F. Tournilhac (ESPCI). Dans les trois cas, le système transite
de la phase ordonnée ferrimagnétique à la phase désordonnée
paramagnétique à une température proche de l’ambiante
(42ºC). Dans les cas (a) et (c), la source d’énergie
peut être la lumière (gratuite avec le soleil) et la source
froide est l’atmosphère. Dans le cas (b), c’est le
milieu ambiant qui est sondé avec une ouverture et fermeture d’un
circuit électrique.

Figure 36 : Trois dispositifs utilisant les propriétés
de l’aimant à précurseur moléculaire VCr à
température de Curie proche de l’ambiante : (a) aimant oscillant,
machine thermodynamique transformant l’énergie lumineuse
en énergie mécanique ; (b) interrupteur magnétique
et sonde thermique ; (c) aimant tournant.
Retour
à la molécule isolée, et bienvenue à la molécule-aimant
Un tout autre domaine, particulièrement attractif, s’est développé
récemment, celui des molécules-aimants. Il s’agit d’obtenir
un solide moléculaire ordonné magnétiquement à
grande distance SANS interaction entre les molécules. La figure 37
résume comment cela peut être possible. La barrière
d’anisotropie, qui permet au moment magnétique de la molécule
de rester dans une direction donnée (donc de garder une information)
est d’origine purement moléculaire. Une fois orientée
dans une direction, l’aimantation du solide moléculaire relaxe
très lentement soit par activation thermique, soit par « effet
tunnel » à travers la barrière d’anisotropie.
C’est une autre des merveilles de la mécanique quantique, celle
de pouvoir franchir des obstacles sans avoir à les sauter.
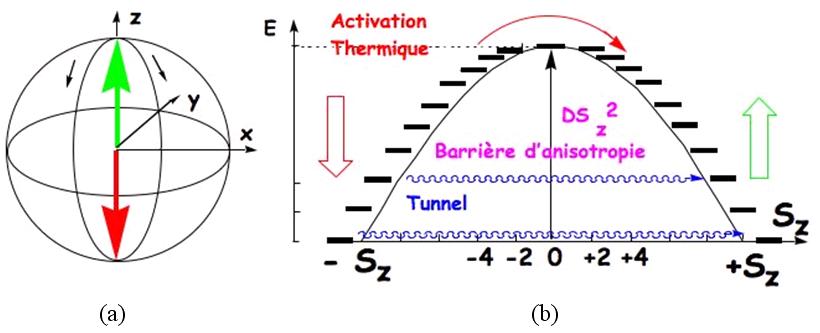
Figure 37 : (a) renversement de l’aimantation
dans un système d’anisotropie axiale ; seules sont favorisées
les orientations le long de l’axe z, vers le haut (vert) ou vers
le bas (rouge) ; (b) un système quantique de spin S élevé,
de constante d’anisotropie D négative est doté d’une
barrière d’anisotropie de valeur DS2 : le renversement
de l’aimantation peut se faire soit en chauffant (moyen banal) soit
par effet tunnel (voir figure 38b).
La première
molécule où a été observé le phénomène
a été synthétisée à Wroclaw (Pologne).
Elle est représentée sur la figure 38a. Les physiciens lui
ont donné « Mn12 » comme nom de bataille. Elle est en
effet constituée de 12 ions manganèse, huit ions Mn(III) et
quatre ions Mn(IV), liés par des ions oxyde et acétate, qui
interagissent pour former un spin S=10 dans l’état fondamental
avec une barrière d’anisotropie importante (environ 70K). La
courbe d’aimantation en fonction du champ, enregistrée à
une température de 2 Kelvins est très remarquable (figure
38b) : elle montre que le cristal moléculaire de Mn12 se comporte
comme un aimant classique, très dur, avec une forte rémanence
et un fort champ coercitif et dans le même temps, comme un système
quantique. Le cycle présente en effet, pour certaines valeurs du
champ magnétique, régulièrement espacées, des
plateaux et des escaliers qui sont la signature de l’effet tunnel
quantique magnétique, observé pour la première fois
en 1993 par plusieurs équipes de chercheurs dont celle de Dante Gatteschi
(Université de Florence) à qui sont dus ces documents.
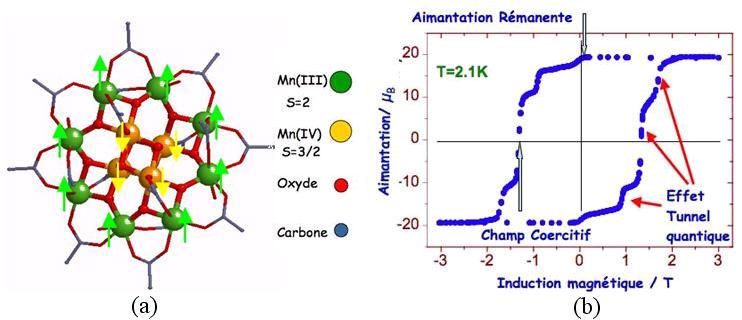
Figure 38 : (a) Structure de la Molécule de
« Mn12 » et structure de spin ; (b) Cycle d’hystérésis
de « Mn12 » montrant le caractère à
la fois classique et quantique du système (communication de D.
Gatteschi et R. Sessoli).
Depuis cette
date, de nombreux systèmes ont été obtenus qui présentent
ces propriétés de relaxation lente de l’aimantation.
La courbe de la figure 39b obtenue sur un magnétomètre très
sensible, un microSQUID, par W. Wernsdorfer de l’Institut Louis Néel
à Grenoble) montre la relaxation lente, variable avec la température,
d’une chaîne-aimant synthétisée par R. Lescouëzec
(Universitad de Valencia et Université Pierre et Marie Curie).
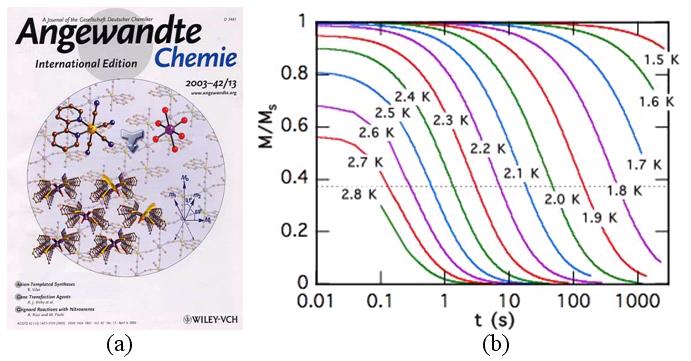
Figure 39 : (a) Couverture d’un journal scientifique
européen annonçant l’apparition d’une nouvelle
chaîne-aimant ; (b) Relaxation lente de l’aimantation de cette
« chaîne-aimant » en fonction de la température
(R. Lescouëzec, M. Julve, W. Wernsdorfer).
Ces systèmes
ouvrent une voie nouvelle vers le stockage de l’information magnétique
à haute densité : il devient possible en effet de rêver
de systèmes moléculaires anisotropes à haut spin, assemblés
à partir de précurseurs subnanométriques, « à
partir du bas » (« bottom up » en anglais), sur lesquels
il serait possible de stocker une information sur une molécule UNIQUE,
comme le montre le schéma de la figure 40. Le défi est formidable
mais c’est un remarquable terrain de travail commun entre chimistes
de synthèse, physiciens quanticiens et technologues.
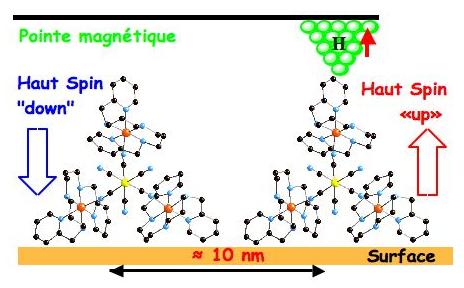
Figure
40 : Un rêve merveilleux : le stockage d’une information magnétique
sur UNE molécule, stade ultime de la densité d’information
possible. Un ensemble de molécules anisotropes à haut spin
refroidies sous champ magnétique alignent leurs moments magnétiques
le long de la direction du champ (vers le bas, en bleu). Une pointe magnétique
s’approche d’une des molécules et à l’aide
d’un très faible champ appliqué retourne l’aimantation
d’une seule molécule : un défi pour les chimistes, les
physiciens et les ingénieurs illustré avec une molécule
« CrNi3 » bien réelle … (elle a été
synthétisée par Valérie Marvaud, Université
Pierre et Marie Curie).
Le merveilleux,
demain
Nous arrivons au terme de cette brève incursion dans le monde des
spins moléculaires qui nous a fait passer du quantique au macroscopique,
de la théorie à l’application, de la formule rigoureuse
au rêve. C’est un domaine en plein développement qui
s’intéresse non seulement au petit, au « nano »
mais aussi au complexe. À une époque où tel prix
Nobel de Chimie japonais affirme qu’aujourd’hui le chimiste
tient à portée de main la synthèse de n’importe
quelle molécule, il est tentant de concevoir et de réaliser
des systèmes de plus en plus complexes, pour répondre à
des besoins nouveaux. Ces systèmes possèdent non plus seulement
une propriété ou une fonction choisie, mais plusieurs fonctions
: c’est le monde des matériaux multifonctionnels. Ces fonctions
peuvent exister côte à côte (magnétisme et transparence)
ou elles peuvent interagir l’une sur l’autre, ou les unes
sur les autres pour créer et mettre en évidence de nouvelles
propriétés. C’est ce qui se produit dans les aimants
chiraux que montre la figure 41. Ces aimants sont construits autour de
l’une des molécules chirales que nous avons manipulée
il y instant en figure 25 avec des ions métalliques choisis comme
nous l’avons fait pour les analogues du bleu de Prusse. Ici, le
pont entre les ions est un oxalate, le plus simple des diacides carboxyliques
organiques [C2O4 ]2-. Comme pour la main,
il existe des aimants droits et des aimants gauches, contrôlés
par le chimiste…
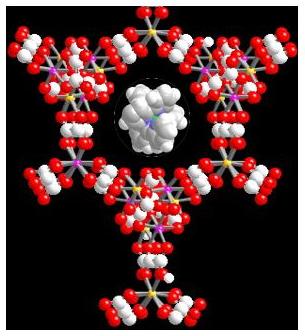
Figure 41 : Aimant chiral (optiquement actif) : un
réseau bimétallique tridimensionnel à pont oxalate
s’enroule autour d’un précurseur chiral (F. Pointillart,
C. Train, M. Gruselle). La présence simultanée des propriétés
magnétiques et de chiralité et leur interaction crée
une troisième propriété.
Parmi les autres
directions riches de développement du magnétisme des systèmes
moléculaires, nous terminons (pas encore avec des expériences
…) en montrant comment l’irradiation par la lumière peut
modifier voire créer les propriétés magnétiques
: commutation moléculaire avec formation de spin élevé
(figure 42), formation d’un aimant (figure 43a) et commutation rapide
à la température ambiante dans un système à
transition de spin (figure 43b).
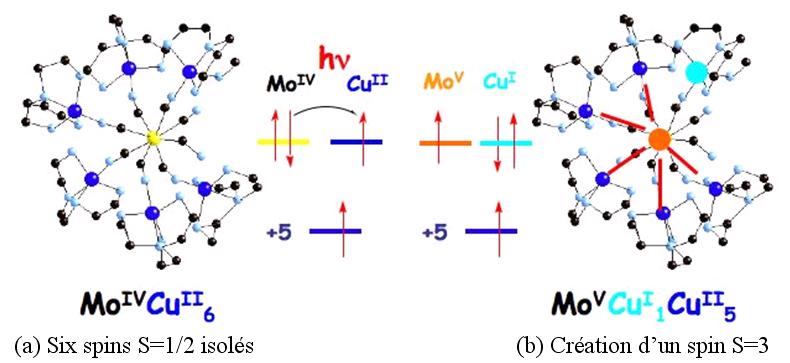
Figure 42 : Une transition électronique transfère un électron
d’un atome métallique à un autre dans un complexe,
« allume » les interactions d’échange et crée
un spin S=3 (J.M. Herrera, V. Marvaud)
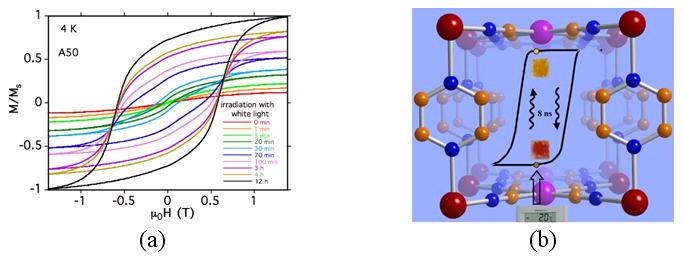
Figure 43 : Deux systèmes photomagnétiques
récents : la lumière transforme un analogue du bleu de Prusse
à base de cobalt et de fer en aimant (a) (A. Bleuzen et W. Wernsdorfer)
et permet une commutation très rapide à la température
ambiante entre deux états magnétiques (A. Bousseksou).
Nous souhaitons
avoir montré que le monde des molécules magnétiques
permet de fournir quelques jolies illustrations pour mieux comprendre, voire
démystifier, le magnétisme et ses applications. Nous voudrions
également avoir convaincu que le monde du magnétisme moléculaire
recèle un potentiel considérable de production de nouveaux
objets magnétiques à propriétés prévisibles
et modulables, beaux, légers, solubles, faciles à mettre en
forme dont certains prendront un jour place dans le vaste ensemble des matériaux
utiles dans notre vie de tous les jours.
|