| "Ephesia":
Un "billard à cellules" pour combattre le cancer.
Institut Curie, UMR168 CNRS/institut Curie/Université Pierre et
Marie Curie et Département d'Oncologie Médicale
Les laboratories
sur puces ou systèmes "microfluidiques" sont actuellement
un domaine en pleine émergence, empruntant aux progrès fantastiques
accomplis au cours des vingt dernières années dans le domaine
des micro et nanosystèmes électroniques. De fait, l’approche
des laboratoires sur puces tente d’appliquer aux analyses biologiques
le principe qui a donné lieu aux microprocesseurs, à savoir
l’intégration sur un support unique microfabriqué,
de l’ensemble des processus nécessaires à l’analyse
d’un produit. Dans le domaine de la biologie et de la médecine,
ce changement de paradigme va apporter des modifications majeures, en
combinaison avec la génomique et la biologie des systèmes,
dont il constitue le partenaire technologique incontournable.
Pour être à la hauteur de ces enjeux, la microfluidique se
heurte à de nombreux défis. En effet, si la microélectronique
manipule l'information transportée par des courants électriques,
c'est à dire des électrons tous identiques, la microfluidique
manipule directement des objets biologiques (cellules, molécules)
et l'information qui est "codée" au sein de ceux-ci.
Ces objets biologiques sont beaucoup plus complexes que les électrons,
ils présentent chacun sa propre "personnalité",
qui va induire des comportements différents et spécifiques
vis à vis des matériaux constituant les puces, des rayonnements
qui vont servir à les analyser. Les cellules ou molécules
biologiques présentent également entre elles des interactions
bien spécifiques, qui vont permettre de les identifier et de les
"décoder", mais sont également une source supplémentaire
de complexité. On comprend donc que le développement de
ces "laboratoires sur puces" implique le travail coordonné
d’équipes très interdisciplinaires, combinant des
compétences en microfabrication, physicochimie, biochimie, chimie
analytique, traitement du signal, automatisme.
On illustrera cette démarche à travers une application médicale
développée à l’Institut Curie, le diagnostic
cellulaire du cancer : aujourd’hui 90% des décès liés
à cette maladie sont le fait des métastases, dues à
la dissémination de cellules dans le sang à partir d’un
cancer primaire vers des sites multiples dans d’autres organes.
Ces métastases on "cancers secondaires" sont souvent
résistants aux traitements ayant permis de traiter les cancers
primaires, il ne suffit donc pas de caractériser ce dernier pour
connaître le traitement le plus efficace pour éviter les
récidives. Il faudrait donc caractériser ces cellules "pionnières",
afin de déterminer le meilleur traitement capable de les éliminer
avant qu'elles ne subissent l'évolution, souvent longue et invisible,
qui les transformera en métastases. Le premier défi est
ici leur rareté. En effet, les premières études cliniques
dans le domaine montrent qu'un patient présentant seulement une
cellule cancéreuse par millilitre de sang (soit au sein de plusieurs
milliards de cellules normales) a déjà un risque significativement
accru de développer des métastases.
A l'Institut Curie, nous développons en partenariat avec plusieurs
laboratoires et hôpitaux étrangers et une startup localisée
à Paris, Fluigent, un système microfluidique capable de
capturer les cellules tumorales dans le sang ou dans des microbiopsies,
puis d'effectuer leur caractérisation moléculaire et de
proposer ainsi aux cliniciens une "carte d'identité"
qui leur permettra de prescrire le meilleur traitement. Cette caractérisation
prend de plus de plus d'actualité, avec le développement
de "thérapies ciblées" de plus en plus pointues
et de stratégies de "médecine personnalisées".
Cette méthode microfludique utilise une sorte de "tamis"
microscopique de billes magnétiques porteuses d'anticorps dirigés
contre les cellules tumorales, qui vont donc les attraper de façon
spécifique (Figures). Des techniques de biologie moléculaire
permettent ensuite d'identifier les mutations spécifiques dont
ces cellules sont porteuses, et qui vont servir de cible à des
médicaments adaptés.
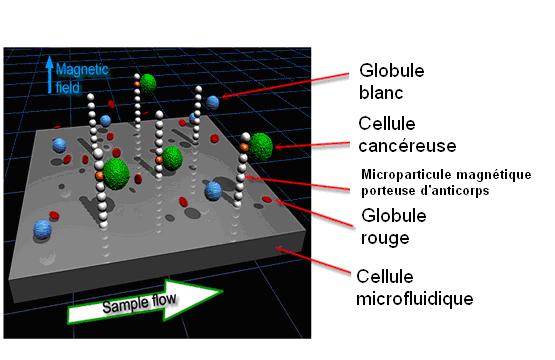
Figure
1: Shéma de principe de la technologie "Ephesia", qui
permet de capturer spécifiquement des celllules cancéreuses
pour effectuer leur caractérisation moléculaire
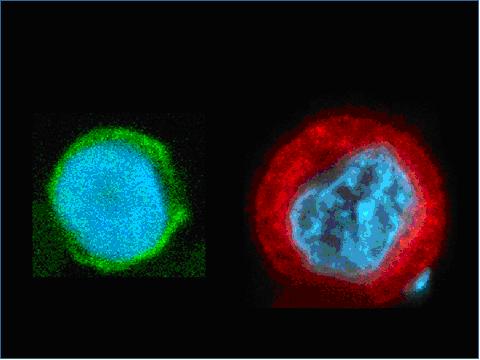
Figure
2: Images d'une cellule normale du sang (globule blanc), à gauche,
et d'une cellule cancéreuse (cellule tumorale de cancer du sein),
à droite, prises dans le système Ephesia après leur
capture. Les cellules ont été marquées avec des molécules
fluorescentes qui représentent respectivement un marqueur spécifique
des lymphocytes (CD45, en vert), un marqueur de cellules tumorales du
sein (cytokératine,n en rouge), et un marqueur de l'ADN (en bleu).
On voit clairement la différence de marquage du cytoplasme des
cellules en vert ou en rouge selon le type de cellule. On voit également
que le noyau (en bleu) de la cellule tumorale est altéré,
avec une répartition de l'ADN beaucoup plus hétérogènes
que pour la cellule normale.
Références
bibliographiques.
[1].. F.C Bidard et coll: Celllules tumorales circulantes
et cancer du sein: techniques de détection et résultats
cliniques, Bulletin du Cancer, 96, 1, 73-86 (2009)
[2] Microfluidic Sorting and Multimodal Typing of Cancer Cells in Self-Assembled
Magnetic Arrays, Saliba AE et al., Proc. National Acad Sci USA, 107, 14524-529
(2010)
|